[전문기술] ADCs(Antibody-Drug Conjugates) 항암제 관련 연구개발 동향
항암제, 표적항암치료, 항체-약물 접합제
Antitumor drugs, Targeted cancer therapy, Antibody-Drug Conjugates
1. 서론
Antibody-drug conjugates(ADCs)는 암 치료 분야에서 주목받는 혁신적인 치료법으로, 전통적인 화
학요법의 한계를 극복하고자 하는 최신 연구의 산물이다. 이러한 치료법은 정밀 의학의 발전과 함께
암세포를 표적으로 하는 특정 항체에 독성이 있는 항암제를 결합함으로써, 암세포를 보다 효과적으
로 사멸시킬 수 있는 가능성을 제시한다. ADCs 의 핵심 구성 요소는 세 가지로, 특정 암세포의 표면
항원을 인식하여 결합하는 항체, 암세포 내로 전달되어 세포 사멸을 유도하는 독성 항암제, 그리고 이
두 요소를 연결하는 링커로 구성된다. 이러한 구조는 암세포에 대한 선택적인 약물 전달을 가능하게
하여 정상세포에 미치는 부작용을 최소화하는 동시에 치료 효과는 극대화한다.
Antitumor drugs, Targeted cancer therapy, Antibody-Drug Conjugates
1. 서론
Antibody-drug conjugates(ADCs)는 암 치료 분야에서 주목받는 혁신적인 치료법으로, 전통적인 화
학요법의 한계를 극복하고자 하는 최신 연구의 산물이다. 이러한 치료법은 정밀 의학의 발전과 함께
암세포를 표적으로 하는 특정 항체에 독성이 있는 항암제를 결합함으로써, 암세포를 보다 효과적으
로 사멸시킬 수 있는 가능성을 제시한다. ADCs 의 핵심 구성 요소는 세 가지로, 특정 암세포의 표면
항원을 인식하여 결합하는 항체, 암세포 내로 전달되어 세포 사멸을 유도하는 독성 항암제, 그리고 이
두 요소를 연결하는 링커로 구성된다. 이러한 구조는 암세포에 대한 선택적인 약물 전달을 가능하게
하여 정상세포에 미치는 부작용을 최소화하는 동시에 치료 효과는 극대화한다.
ADCs 의 개발과 사용은 암 치료 전략에서 중요한 전환점을 의미한다. 특히 전통적인 화학요법이
가지는 광범위한 세포독성과 비특이적 약물 전달 문제를 해결하고자 하는 노력의 일환으로, 이러한
치료법은 암세포의 특정 표적에 초점을 맞춤으로써 보다 개인화되고 효과적인 치료 결과를 도모할
수 있다. 현재 이러한 특장점을 바탕으로 국내외 다수의 제약사에서 가장 연구개발에 집중하고 있는
기술이기도 하다. 본 보고서는 ADCs 의 기본 원리, 구성 요소, 작용 메커니즘을 소개하고, 이 치료법
이 직면한 주요 도전 과제 및 내성 문제에 대해 논의하고자 한다. 이를 통해 ADCs 의 발전이 암 치료
에서 어떤 의미가 있으며, 어떤 방식으로 암 치료 패러다임을 변화시키고 있는지에 대한 포괄적인 이
해를 제공하고자 한다.
2. 본론
2.1. ADCs 의 역사적 배경: 초기 항암 치료법에서 현대의 ADCs 까지의 발전 과정
암 치료의 역사는 초기의 단순하고 광범위한 접근법에서 정밀하고 표적화된 치료법으로의 발전을
거쳐왔다. 처음에는 화학요법이 주된 치료법으로 사용되었으나, 이는 암세포뿐만 아니라 정상세포도
손상시키는 단점이 있었다. 이에 따라, 더 세밀하고 특정한 암세포를 표적으로 할 수 있는 방법의 필
요성이 대두되었다.
1980 년대에 들어서며, 과학자들은 항체를 이용해 암세포 특정 항원을 표적으로 하는 방법을 모색
하기 시작했다. 이러한 연구는 항체를 약물과 결합시키는 아이디어로 발전했고, 이것이 바로 항체-약
물 결합체(ADCs)의 기원이다. ADCs 는 암세포에 특이적인 항원을 인식하는 항체와, 그 항체에 결합
된 고도로 독성이 있는 약물로 구성된다. 이 항체는 암세포에 결합한 후 약물을 암세포 내부로 전달
함으로써, 암세포를 선택적으로 파괴할 수 있게 한다.
이러한 접근법은 정상세포에 대한 손상을 최소화하면서 암세포를 효과적으로 파괴할 수 있는 잠재
력이 있어, 암 치료 분야에서 큰 관심을 받게 되었다. ADCs 의 개발은 다양한 과제와 함께 진행되었
으며, 특히 약물의 효과적인 전달, 항체와 약물을 연결하는 링커의 안정성, 그리고 암세포의 내성 문
제 등이 중요한 연구 주제가 되었다.
2000 년대에 들어서며, 여러 ADCs 가 임상시험을 거치고 일부는 FDA 의 승인을 받기 시작했다. 이
들은 특히 기존의 치료법으로는 효과를 보기 어려운 특정 유형의 암에서 중요한 치료 옵션으로 자리
잡아가고 있다. ADCs 의 발전은 지속적으로 진행되고 있으며, 더 효과적인 항체 발견, 새로운 표적 항
원의 탐색, 그리고 내성 메커니즘을 극복하기 위한 전략 개발 등을 통해 앞으로도 암 치료 분야에서
중요한 역할을 할 것으로 기대할 수 있다.
2.2. ADCs 의 구성 요소 및 작용 메커니즘
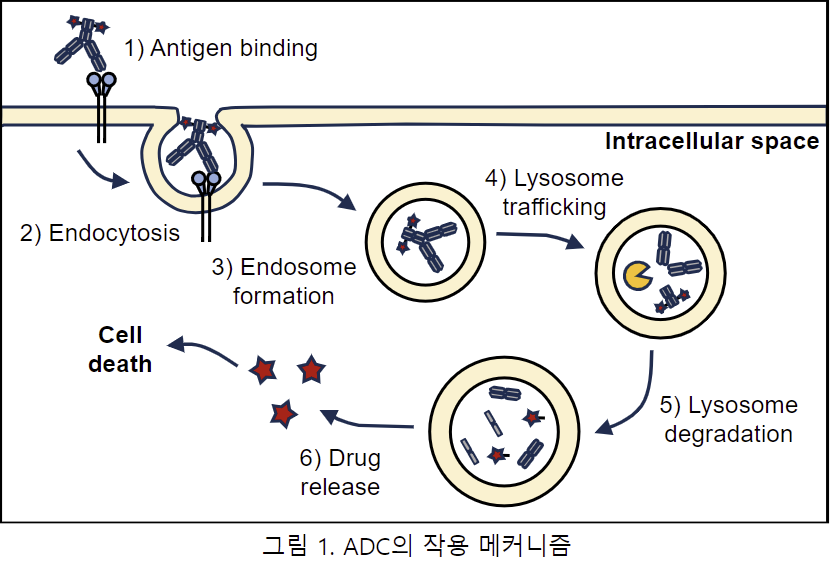
항체-약물 결합체(ADCs)는 항체, 세포독성 약물, 화학적 링커로 구성된다. ADCs 가 표적세포에 도
달하면 단일클론항체(mAb)가 세포 표면 항원을 인식하여 결합하고, ADCs-항원 복합체는 암세포 내
에서 엔도사이토시스에 의해 내재화되어 초기 엔도좀(early endosome)을 형성하고, 성숙한 후 후기
엔도좀을 형성하여 최종적으로 리소좀과 융합한다. 그런 다음 세포독성 약물은 리소좀에서 화학반응
또는 효소분해를 통해 mAb 에서 방출되어 세포독성 효과를 발휘하여 세포 자살(Apoptosis) 또는 사
멸을 유발한다.
항체-약물 접합체(ADCs) 설계에 있어 적절한 표적 항원의 선택은 필수적이다. 우선, 항원은 종양 세
포에서만 독점적으로 또는 주로 발현되어야 하며, 이는 비표적 독성을 줄이기 위함이다. 둘째로, 표적
항원과의 결합은 이상적으로 항원-항체 복합체의 내부화를 유도해야 한다. 또한 항체에 의해 인식될
수 있도록 내부가 아닌 세포 표면에 있어야 하며, 마지막으로, 세포 외부로 분비되는 항원이 아니어 야 한다.
FDA 에서 승인한 ADCs 의 표적 항원은 혈액학적 악성 종양에서는 CD19, CD22, CD30, CD33,
CD79b 이며, 고형암에서는 HER2, trop2, nectin4, 조직 인자 및 엽산 수용체 알파(FRα)이다. 이상적인
항체 부분은 효과적인 내부화를 촉진하고, 항원 친화력이 높으며, 긴 혈장 반감기를 유지하고, 낮은
면역원성을 보여야 한다.
CD79b 이며, 고형암에서는 HER2, trop2, nectin4, 조직 인자 및 엽산 수용체 알파(FRα)이다. 이상적인
항체 부분은 효과적인 내부화를 촉진하고, 항원 친화력이 높으며, 긴 혈장 반감기를 유지하고, 낮은
면역원성을 보여야 한다.
이러한 다양한 ADCs 의 특성은 연결체(Conjugation) 화학에 의해서도 영향을 받으며, 여기에는 특
이성, 안정성, 효능, 독성이 포함된다. 세포 내에서 유효성분을 방출하는 방법에 따라, 가수분해 가능
한 연결체와 비가수분해 연결체 등 두 가지 유형이 있다. 가수분해 가능한 연결체는 화학적으로 불안
정하거나 효소적으로 불안정하다. Hydrazone 연결체는 일반적으로 알칼리 환경에서 안정적이며, 리
소좀 및 엔도좀과 같은 저 pH 환경에서 가수분해된다. 따라서 hydrazone 연결체를 가진 ADCs 의 절
단은 주로 리소좀 및 엔도좀 내부화 후에 발생하며, 플라스마에서의 간헐적인 가수분해로 인해 비표
적, 전신 독성을 야기한다. 마찬가지로 disulfide 결합 연결체는 혈장 내에서 안정적일 수 있으며, 비교
적 높은 환원성 글루타티온 성분을 가진 암세포에서 특이적으로 활성 유효성분을 방출할 수 있다. 효
소에 민감한 연결체는 일반적으로 암세포에서 과발현되는 리소좀 프로테아제에 민감하여 내부화된
후 세포 내에서 정확한 약물 방출을 가능하게 한다. 비가수분해 연결체를 가진 ADCs 는 플라스마에
서 화학적 또는 효소적 소화에 저항력이 있으며, 유효성분을 방출하기 위해 후기 엔도좀 및 리소좀
내에서 항체의 완전한 분해를 필요로 한다. 따라서 비가수분해 연결체를 가진 ADCs 는 증가된 혈장
내 안정성으로 인해 표적 외 독성이 낮아 안전성이 높으며, 따라서 항원 표현이 균일한 종양 치료에
가장 적합할 수 있다. 예를 들어 Trastuzumab deruxtecan 은 가수분해 가능한 효소 연결체를 가지고
있는 반면, trastuzumab emtansine 은 가수분해 불가능한 티오에테르(Thioether) 연결체를 가지고 있
다. Deruxtecan, MMAE 또는 maytansinoid DM4 와 같은 유효성분은 세포막을 투과할 수 있으며, 리
소좀에서 절단된 후 세포 밖으로 확산될 수 있다. 따라서 그 구성 요소의 특성에 의해 TDXd 는 우회
적 효과를 가지며, 낮은 Her2 발현을 가진 종양에서도 효과적이다.
이성, 안정성, 효능, 독성이 포함된다. 세포 내에서 유효성분을 방출하는 방법에 따라, 가수분해 가능
한 연결체와 비가수분해 연결체 등 두 가지 유형이 있다. 가수분해 가능한 연결체는 화학적으로 불안
정하거나 효소적으로 불안정하다. Hydrazone 연결체는 일반적으로 알칼리 환경에서 안정적이며, 리
소좀 및 엔도좀과 같은 저 pH 환경에서 가수분해된다. 따라서 hydrazone 연결체를 가진 ADCs 의 절
단은 주로 리소좀 및 엔도좀 내부화 후에 발생하며, 플라스마에서의 간헐적인 가수분해로 인해 비표
적, 전신 독성을 야기한다. 마찬가지로 disulfide 결합 연결체는 혈장 내에서 안정적일 수 있으며, 비교
적 높은 환원성 글루타티온 성분을 가진 암세포에서 특이적으로 활성 유효성분을 방출할 수 있다. 효
소에 민감한 연결체는 일반적으로 암세포에서 과발현되는 리소좀 프로테아제에 민감하여 내부화된
후 세포 내에서 정확한 약물 방출을 가능하게 한다. 비가수분해 연결체를 가진 ADCs 는 플라스마에
서 화학적 또는 효소적 소화에 저항력이 있으며, 유효성분을 방출하기 위해 후기 엔도좀 및 리소좀
내에서 항체의 완전한 분해를 필요로 한다. 따라서 비가수분해 연결체를 가진 ADCs 는 증가된 혈장
내 안정성으로 인해 표적 외 독성이 낮아 안전성이 높으며, 따라서 항원 표현이 균일한 종양 치료에
가장 적합할 수 있다. 예를 들어 Trastuzumab deruxtecan 은 가수분해 가능한 효소 연결체를 가지고
있는 반면, trastuzumab emtansine 은 가수분해 불가능한 티오에테르(Thioether) 연결체를 가지고 있
다. Deruxtecan, MMAE 또는 maytansinoid DM4 와 같은 유효성분은 세포막을 투과할 수 있으며, 리
소좀에서 절단된 후 세포 밖으로 확산될 수 있다. 따라서 그 구성 요소의 특성에 의해 TDXd 는 우회
적 효과를 가지며, 낮은 Her2 발현을 가진 종양에서도 효과적이다.
반면에 trastuzumab emtansine 은 Intracellular space
1) Antigen binding
2) Endocytosis
3) Endosome
formation
4) Lysosome
trafficking
5) Lysosome
degradation6) Drug
release
Cell
death
그 특성으로 인해 낮은 독성 프로파일을 가진다. 반대로, 종양 세포 밖으로 침투하는 유효성분 분자
로 인한 바람직하지 않은 전신 독성을 줄이기 위해, 이온화 가능한 유효성분을 사용할 수 있다. 현재
까지 trastuzumab emtansine 은 가수분해 불가능한 연결체를 사용하는 유일한 승인된 ADCs 이며, 나
머지 ADCs 는 가수분해 가능한 연결체를 갖추고 있다. 보다 안정적이고 뛰어난 ADCs 를 위해 연결체
결합 등을 위한 새로운 연구가 지속적으로 진행되고 있다.
2.3. 임상 적용 사례
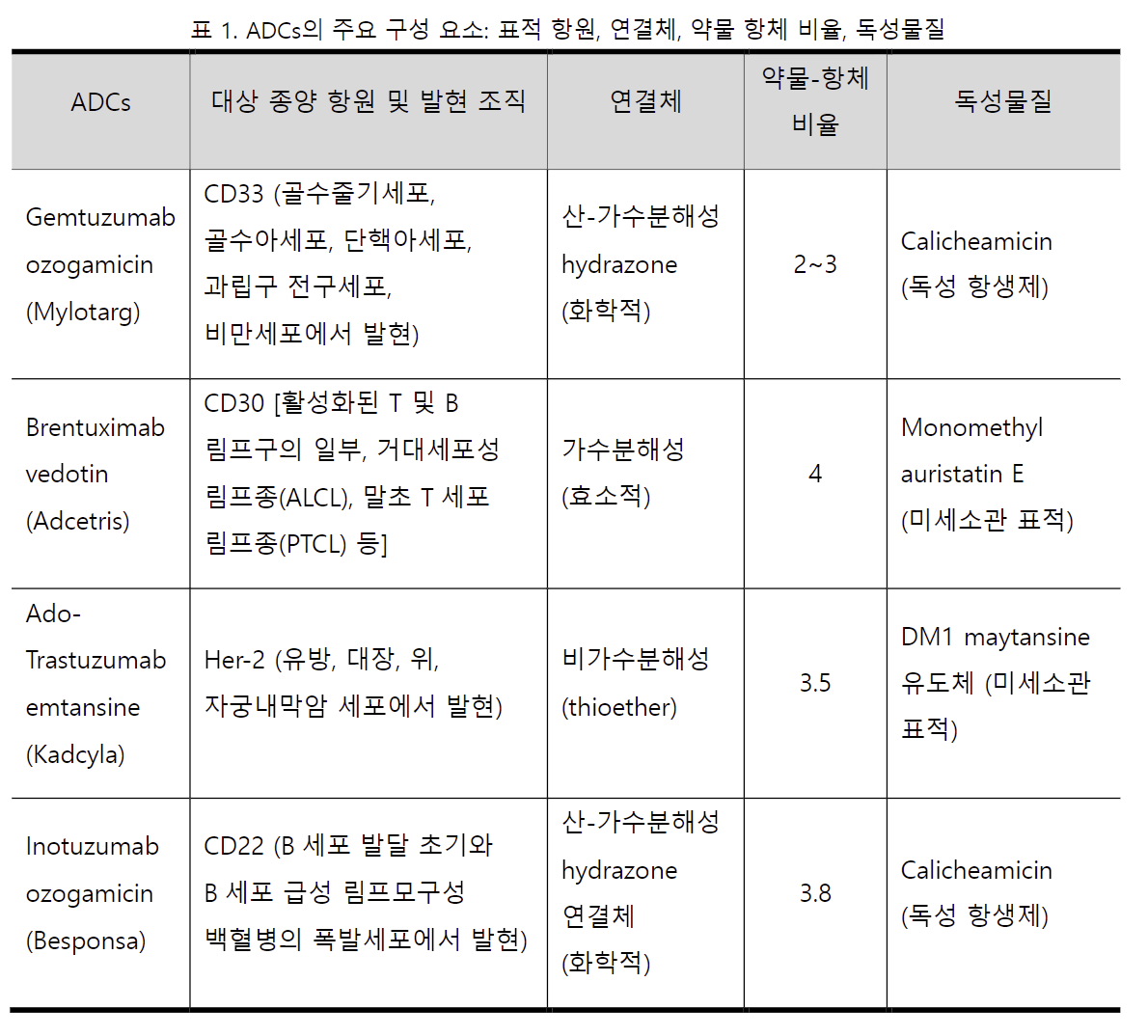
Gemtuzumab Ozogamicin 은 급성골수성백혈병(AML, Acute Myeloid Leukemia) 치료에 사용되는
항체-약물 접합체(ADCs)이다. 이 약물은 CD33 항원을 표적으로 하는 단클론항체와 강력한 항암제인
Calicheamicin 을 결합한 형태로, 특정 AML 세포를 선택적으로 파괴하는 치료법이다.
Gemtuzumab Ozogamicin 은 1990 년대 후반에 시작되었으며, 초기 임상시험을 통해 AML 환자들
에서 효과를 보였다. 2000 년대 초에 미국 식품의약국(FDA)의 조건부 승인을 받았지만, 기대한 효과를 충분히 입증하지 못하고 부작용이 보고됨에 따라 2010 년에 시장에서 철회되었다.
로 인한 바람직하지 않은 전신 독성을 줄이기 위해, 이온화 가능한 유효성분을 사용할 수 있다. 현재
까지 trastuzumab emtansine 은 가수분해 불가능한 연결체를 사용하는 유일한 승인된 ADCs 이며, 나
머지 ADCs 는 가수분해 가능한 연결체를 갖추고 있다. 보다 안정적이고 뛰어난 ADCs 를 위해 연결체
결합 등을 위한 새로운 연구가 지속적으로 진행되고 있다.

2.3. 임상 적용 사례
Gemtuzumab Ozogamicin 은 급성골수성백혈병(AML, Acute Myeloid Leukemia) 치료에 사용되는
항체-약물 접합체(ADCs)이다. 이 약물은 CD33 항원을 표적으로 하는 단클론항체와 강력한 항암제인
Calicheamicin 을 결합한 형태로, 특정 AML 세포를 선택적으로 파괴하는 치료법이다.
Gemtuzumab Ozogamicin 은 1990 년대 후반에 시작되었으며, 초기 임상시험을 통해 AML 환자들
에서 효과를 보였다. 2000 년대 초에 미국 식품의약국(FDA)의 조건부 승인을 받았지만, 기대한 효과를 충분히 입증하지 못하고 부작용이 보고됨에 따라 2010 년에 시장에서 철회되었다.
그러나 이후 원제약사가 Pfizer 에 인수된 후 추가 연구와 데이터분석을 통해 2017 년에 FDA 에 의해 Mylotarg 라는
이름으로 재승인되었다. Gemtuzumab Ozogamicin 은 AML 세포 표면의 CD33 항원에 결합하는 단클
론항체와, 항체에 결합된 항암제인 Calicheamicin 으로 구성된다. 약물과 항체는 산-가수분해성 hydra-
zone 연결체에 의해서 결합되어 있다. 약물이 AML 세포에 결합하고 내부화된 후, Calicheamicin 이
방출되어 세포 내 DNA 와 결합하여 DNA 를 파괴하고 세포 사멸을 유도하는 원리로 작용한다.
이름으로 재승인되었다. Gemtuzumab Ozogamicin 은 AML 세포 표면의 CD33 항원에 결합하는 단클
론항체와, 항체에 결합된 항암제인 Calicheamicin 으로 구성된다. 약물과 항체는 산-가수분해성 hydra-
zone 연결체에 의해서 결합되어 있다. 약물이 AML 세포에 결합하고 내부화된 후, Calicheamicin 이
방출되어 세포 내 DNA 와 결합하여 DNA 를 파괴하고 세포 사멸을 유도하는 원리로 작용한다.
Brentuximab Vedotin 은 호지킨림프종(Hodgkin Lymphoma) 및 시스템성 악성 대세포 B-세포 림프
종(Systemic Anaplastic Large Cell Lymphoma)과 같은 특정 유형의 림프종 치료에 사용되는 항체-약
물 접합체(ADCs)이다. 이 약물은 CD30 양성 암세포를 표적으로 하는 단일클론항체와, 항암제인
Monomethyl auristatin E 를 결합한 형태로, 특정 림프종 세포의 미세소관을 타기팅하여 선택적으로
파괴하는 방식이다.
Brentuximab Vedotin 은 Seagen Inc.(구 Seattle Genetics)와 Takeda Pharmaceutical Company 에 의
해 공동개발되었다. CD30 양성 림프종 세포를 표적으로 하는 새로운 치료 옵션의 필요성에 대한 인
식에서 출발했으며, 2011 년에 미국 식품의약국(FDA)으로부터 Adcetris 라는 이름으로 승인을 받았다.
Brentuximab Vedotin(BV)은 이전에 두 번 이상 치료받고도 다시 암이 돌아온 호지킨림프종 환자들,
자가 줄기세포 이식을 받았지만 암이 재발한 환자들, 또는 이식수술을 받을 수 없는 환자들을 대상으
로 한 연구에서 사용되었다. 이 연구에는 102 명의 환자가 참여했고, 이들은 BV 로 치료받았다. 치료
결과 참여자들의 75%가 암이 줄어드는 긍정적인 반응을 보였고, 이 중 34%는 암이 완전히 사라진 완
전반응을 경험했다. 치료받은 환자들은 평균적으로 약 5.6 개월 동안 암이 진행되지 않았으며, 완전반
응을 보인 환자들은 평균 20.5 개월 동안 암이 다시 나타나지 않았다. 전체적으로, 환자들은 평균적으
로 22.4 개월 동안 생존했다.
Ado-Trastuzumab Emtansine(또는 T-DM1)은 HER2 양성 유방암 치료에 사용되는 항체-약물 접합
체(ADCs)이다. HER2 는 유방암 세포의 성장과 분열을 촉진하는 단백질로, 일부 유방암 환자에서 과발
현된다. T-DM1 의 개발은 HER2 양성 유방암 치료의 효율성을 높이고 부작용을 최소화하기 위한 목
적으로 시작되었다. 이 약물은 HER2 단백질에 특이적으로 결합하는 Trastuzumab 항체와, 세포독성
화학요법 약물인 DM1 을 결합한 형태로, 세포 외부에서는 끊어지지 않는 연결체로 결합되어 있어 순
환계와 암 조직의 미세환경에서는 안정한 형태로 존재한다. 이 약물은 HER2 양성 암세포에 결합하고
내부화된 후, lysosome 의 분해작용에 의해 DM1 이 세포 내로 방출되어 세포 내 미세소관 네트워크
를 방해하고, 세포분열을 억제하여 암세포를 파괴한다.
2013 년 2 월 22 일, FDA 는 trastuzumab 와 taxane 계 약물을 이미 투여받은 적이 있는 HER2 양성
전이성 유방암 환자들을 위해 trastuzumab Emtansine(Kadcyla, Roche)을 승인했다. 이 결정은 EMILIA
라는 3 상 임상시험에 기반을 두고 있다. 이 시험에는 HER2 양성 전이성 유방암 환자 991 명이 참여
하여, 한 그룹은 Ado-Trastuzumab Emtansine 을 투여받았고 다른 그룹은 lapatinib 과 capecitabine 을
투여받았다. 시험 결과, Ado-Trastuzumab Emtansine 을 받은 그룹은 43.6%의 반응률을 보였고, 다른
그룹은 30.8%의 반응률을 보였다. 또한 Ado-Trastuzumab Emtansine 그룹의 평균 무진행생존기간은
전이성 유방암 환자들을 위해 trastuzumab Emtansine(Kadcyla, Roche)을 승인했다. 이 결정은 EMILIA
라는 3 상 임상시험에 기반을 두고 있다. 이 시험에는 HER2 양성 전이성 유방암 환자 991 명이 참여
하여, 한 그룹은 Ado-Trastuzumab Emtansine 을 투여받았고 다른 그룹은 lapatinib 과 capecitabine 을
투여받았다. 시험 결과, Ado-Trastuzumab Emtansine 을 받은 그룹은 43.6%의 반응률을 보였고, 다른
그룹은 30.8%의 반응률을 보였다. 또한 Ado-Trastuzumab Emtansine 그룹의 평균 무진행생존기간은
9.6 개월이었고, 다른 그룹은 6.4 개월이었다. 전체 생존기간 또한 Ado-Trastuzumab Emtansine 그룹
이 30.9 개월로 다른 그룹의 25.1 개월보다 길었음을 밝혔다. 이 결과는 Ado-Trastuzumab Emtansine
이 HER2 양성 전이성 유방암 치료에 효과적임을 보여주었다.
2.4. 한계 및 도전 과제
항체-약물 접합체(ADCs)는 정밀한 암 치료 전략으로 주목받고 있으나, 이 기술의 성공적인 적용에
는 여러 한계와 도전 과제가 존재한다.
첫째, 표적 항원의 선택: ADCs 는 특정 항원을 표적으로 하여 암세포를 선택적으로 공격하는 전략
이다. 하지만 모든 암세포에서 특이적이고 일관되게 표현되는 항원을 찾는 것은 매우 어려운 과
제이다. 따라서 비특이적 결합으로 인해 정상세포도 손상을 입을 수 있으며, 이는 부작용과 독성
문제로 이어질 수 있다.
둘째, 링커의 안정성: ADCs 의 효과는 링커의 안정성에 크게 좌우된다. 링커가 너무 안정적이면 약
물이 암세포 내에서 적절히 방출되지 않을 수 있으며, 반대로 너무 불안정하면 정상 조직에서 조
기에 방출되어 부작용을 일으킬 수 있다. 따라서 연결체의 생화학적 및 생리학적 특성을 이해하
고 설계 및 최적화하는 것이 중요하다.
셋째, 약물 부하(DAR, Drug antibody ratio)의 최적화: 약물 부하는 ADCs 의 효능과 안정성에 중
요한 영향을 미친다. 높은 DAR 은 효능을 증가시킬 수 있으나, 동시에 용해도 문제, 항체의 구조
적 안정성 저하, 그리고 체내 분포 및 제거에 부정적인 영향을 줄 수 있다. 최적의 DAR 를 결정
하는 것은 ADCs 개발의 핵심 과제 중 하나이다.
넷째, 내성 문제: 암세포는 다양한 기전을 통해 ADCs 치료에 대한 내성을 개발할 수 있다. ADCs 는
전통적인 화학항암제에 비해 타깃화되어 최소한의 약물을 사용하게 되므로 비교적 내성 발생을
줄일 수 있다. 그러나 작용 방식은 마찬가지로 화학항암제에 기반하고 있는 ADCs 의 경우에도
다약제 내성을 일으킬 수 있다. 따라서 내성 메커니즘을 이해하고 이를 극복하기 위한 새로운
ADCs 설계 전략이 요구된다.
3. 결론
ADCs 는 암 치료 분야에서 혁신적인 치료법으로 주목받고 있다. 이 보고서에서는 그 기본 원리, 구
성 요소, 작용 메커니즘을 소개하고, 임상 적용 사례를 살펴보았다. ADCs 의 개발은 암 치료 분야에서
중요한 전환점을 의미하며, 특히 암세포의 특정 표적에 초점을 맞춤으로써 개인화된 치료 결과를 도
이 30.9 개월로 다른 그룹의 25.1 개월보다 길었음을 밝혔다. 이 결과는 Ado-Trastuzumab Emtansine
이 HER2 양성 전이성 유방암 치료에 효과적임을 보여주었다.
2.4. 한계 및 도전 과제
항체-약물 접합체(ADCs)는 정밀한 암 치료 전략으로 주목받고 있으나, 이 기술의 성공적인 적용에
는 여러 한계와 도전 과제가 존재한다.
첫째, 표적 항원의 선택: ADCs 는 특정 항원을 표적으로 하여 암세포를 선택적으로 공격하는 전략
이다. 하지만 모든 암세포에서 특이적이고 일관되게 표현되는 항원을 찾는 것은 매우 어려운 과
제이다. 따라서 비특이적 결합으로 인해 정상세포도 손상을 입을 수 있으며, 이는 부작용과 독성
문제로 이어질 수 있다.
둘째, 링커의 안정성: ADCs 의 효과는 링커의 안정성에 크게 좌우된다. 링커가 너무 안정적이면 약
물이 암세포 내에서 적절히 방출되지 않을 수 있으며, 반대로 너무 불안정하면 정상 조직에서 조
기에 방출되어 부작용을 일으킬 수 있다. 따라서 연결체의 생화학적 및 생리학적 특성을 이해하
고 설계 및 최적화하는 것이 중요하다.
셋째, 약물 부하(DAR, Drug antibody ratio)의 최적화: 약물 부하는 ADCs 의 효능과 안정성에 중
요한 영향을 미친다. 높은 DAR 은 효능을 증가시킬 수 있으나, 동시에 용해도 문제, 항체의 구조
적 안정성 저하, 그리고 체내 분포 및 제거에 부정적인 영향을 줄 수 있다. 최적의 DAR 를 결정
하는 것은 ADCs 개발의 핵심 과제 중 하나이다.
넷째, 내성 문제: 암세포는 다양한 기전을 통해 ADCs 치료에 대한 내성을 개발할 수 있다. ADCs 는
전통적인 화학항암제에 비해 타깃화되어 최소한의 약물을 사용하게 되므로 비교적 내성 발생을
줄일 수 있다. 그러나 작용 방식은 마찬가지로 화학항암제에 기반하고 있는 ADCs 의 경우에도
다약제 내성을 일으킬 수 있다. 따라서 내성 메커니즘을 이해하고 이를 극복하기 위한 새로운
ADCs 설계 전략이 요구된다.
3. 결론
ADCs 는 암 치료 분야에서 혁신적인 치료법으로 주목받고 있다. 이 보고서에서는 그 기본 원리, 구
성 요소, 작용 메커니즘을 소개하고, 임상 적용 사례를 살펴보았다. ADCs 의 개발은 암 치료 분야에서
중요한 전환점을 의미하며, 특히 암세포의 특정 표적에 초점을 맞춤으로써 개인화된 치료 결과를 도
모할 수 있다. 그러나 ADCs 의 적용에는 여러 가지 도전 과제와 한계가 존재한다. 표적 항원 선택의
어려움, 연결체의 선택, 약물 부하 최적화, 내성 문제 등이 그 중요한 요소이다. 이러한 도전 과제를 극
복하고 ADCs 를 효과적으로 활용하기 위해서는 지속적인 연구와 혁신이 필요하다. 암 치료 분야에서
미래에는 더 많은 발전과 향상된 ADCs 의 등장을 기대할 수 있으며, 이를 통해 환자들에게 더 나은
치료 옵션을 제공할 수 있을 것으로 전망한다.
어려움, 연결체의 선택, 약물 부하 최적화, 내성 문제 등이 그 중요한 요소이다. 이러한 도전 과제를 극
복하고 ADCs 를 효과적으로 활용하기 위해서는 지속적인 연구와 혁신이 필요하다. 암 치료 분야에서
미래에는 더 많은 발전과 향상된 ADCs 의 등장을 기대할 수 있으며, 이를 통해 환자들에게 더 나은
치료 옵션을 제공할 수 있을 것으로 전망한다.
'전문기술' 카테고리의 다른 글
| [전문기술] 난치성 폐질환(Intractable Lung Disease) (48) | 2024.02.28 |
|---|---|
| [전문기술] 한국화학연구원과 광주과학기술원 연구팀이 항암제 내성을 극복할 수 있는 새로운 표적 단백질을 발견했다. (35) | 2024.02.26 |
| [전문기술] 피어스바이오텍, 15대 혁신적 바이오기업 선정 (61) | 2024.02.19 |
| [전문기술] 새로운 패혈증 치료법을 개발할 수 있는 가능성을 제시했다. (96) | 2024.02.08 |
| [전문기술] 실험실 쥐가 아닌 야생시궁쥐에서 E형 간염바이러스를 처음으로 검출했다. 서울과 제주 지역에서 채집한 집쥐 중 4.4%가 E형 간염 바이러스에 감염된 것으로 확인된다. (103) | 2024.02.02 |



