[전문기술] 인도에서 개발한 CAR-T, 치료비용 1/10로 저렴

| ◇인도의 한 작은 바이오텍 회사(ImmunoACT)가 선진국에서 개발된 첨단 항암제인 CAR-T 세포치료제의 자체 버전(NexCAR19)을 생산. 치료비는 선진국에서 개발한 CAR-T 치료제의 1/10로, 시장에 큰 충격과 함께 변화를 유도할 것으로 예상 ▸주요 출처 : Nature News, Cutting-edge CAR-T cancer therapy is now made in India - at one-tenth the cost, 2024.3.21 |
■ 인도의 한 작은 바이오텍 회사가 선진국에서 개발된 첨단 항암제인 CAR-T 세포치료제의 자체 버전(NexCAR19)을 생산
○ 치료비는 선진국에서 개발한 CAR-T 세포치료제(chimeric antigen receptor T cell therapy)의 1/10로, 시장에 큰 충격과 함께 변화를 유도할 것으로 예상
- 인도 뭄바이에 기반을 둔 ImmunoACT사에서 개발한 NexCAR19의 1회 치료 비용은 3만∼4만 달러로, 1/10로 저렴
※ 미국에서 승인된 첫 CAR-T 치료제(Kymriah, 킴리아)의 치료 비용은 37만∼53만 달러 사이(병원 비용과 부작용 치료 약물 비용은 불포함)
- 2023년 10월 NexCAR19 사용을 승인받은 후 12월부터 치료를 시작
※ 현재 인도 전역의 병원에서 매월 약 20명의 환자가 치료를 받고 있다고 설명
< ImmunoACT사의 파이프라인 현황 >

■ ImmunoACT사는 마우스 유래 항체 끝에 인체 단백질을 추가하며 인간화된(humanized) CAR를 개발
○ 일반적으로 CAR-T 치료제는 환자의 T세포를 채취한 후 암세포를 찾아 제거할 수 있도록 유전적으로 변형시키는데,
- 이 과정에서 특정 암세포 항원을 인식할 수 있도록 CAR(Chimeric Antigen Receptor, 키메라 항원 수용체)를 설계하여 T세포 표면에 도입
- 기존에 승인된 CAR-T 치료제 대부분은 마우스에서 유래된 항체 조각을 CAR의 일부로 사용
※ 이러한 마우스 기반 항체는 인체 면역체계에서 외부 물질로 인식하여 치료 후 일정 시간이 지나면 이를 제거하여 치료의 효과가 감소할 수 있음
○ NexCAR19는 마우스 유래 항체 끝에 인체 단백질을 추가하여 인간화된(humanized) CAR를 개발
- 인간화된 CAR는 마우스 유래 CAR와 비교하여 유사한 항암 활성을 보였으며, 사이토카인의 생성을 더 낮은 수준으로 유도한다는 중요한 발견* 또한 제시
* CAR-T 치료를 받는 일부 암 환자들은 사이토카인 방출 증후군(cytokine-release syndrome)이라는 생명을 위협하는 염증 부작용을 겪을 수 있음
- NexCAR19의 초기 임상시험에서 다양한 형태의 림프종과 백혈병 환자 33명 중 19명의 종양이 1개월 후 완전히 사라졌으며, 또 다른 4명의 환자는 종양이 절반으로 줄어들어 전체 반응률이 70%
※ 임상시험 참가자들은 최소 5년 동안 추적 관찰될 예정
○ ImmunoACT사는 인도에서 제품을 개발, 임상시험 및 제조하여 비용을 절감
- 또한 고가의 렌티 바이러스(lentivirus)*를 사용하는 대신 CAR 유전자를 T세포에 도입하기 위한 유전자 전달 수단(gene-delivery vehicle)을 직접 개발
* 50명의 임상시험을 위해 충분한 양의 렌티 바이러스 벡터(lentiviral vector)를 구입하는 데 미국에서 최대 80만 달러까지 소요
- 이외에도 고가의 자동화 기계를 사용하지 않고 세포를 대량 생산할 수 있는 방법을 고안했으며, 이 치료제의 안전성이 기존에 승인된 제품보다 개선되어 환자의 비용이 추가로 절감되었다고 설명
○ ImmunoACT는 멕시코 수출과 다발성 골수종(multiple myeloma) 등 다른 혈액암 치료제 개발을 계획
- 그러나 ImmunoACT는 인도 벵갈루루의 Immuneel Therapeutics사* 등 몇몇 인도 회사들과의 경쟁에 직면
* 스페인 과학자들이 개발한 기술을 라이센스하여 현지 CAR-T 임상 시험을 시작
참고1 유전자 편집 CAR-T에 의한 환자 맞춤형 암 치료
| ◇ 환자의 종양별로 특징적인 돌연변이 단백질을 인식할 수 있도록 유전자 편집기술로 고도화한 T세포는 2개의 첨단 바이오기술(CRISPR 유전자 편집기술, CAR-T 치료기술)을 결합한 새로운 치료방법으로, 그 효과를 확인하는 첫 번째 소규모 임상시험에서 가능성을 제시 ▸주요 출처 : Nature, CRISPR cancer trial success paves the way for personalized treatments, 2022.11.10 |
■ CRISPR 등 유전자 편집기술을 활용하여 다양한 질병을 치료하기 위한 임상시험이 진행 중
○ 임상시험은 유전자 편집기술에 의해 변형된 세포를 주입하는 ex vivo 방식과 유전자 편집 도구를 인체에 직접 주입하는 in vivo 방식으로 구분할 수 있으며,
- HIV, 혈우병, 단일 유전질환, 혈액암 및 림프암, 고형암 등 다양한 질병 치료를 위해 임상시험이 진행 중
- 특히 ex vivo 방식의 유전자 편집기술은 차세대 항암치료제로 주목받고 있는 CAR-T 기술을 더욱 고도화할 수 있을 것으로 기대
< 유전자 편집기술을 활용한 치료제, 치료기술 임상시험 현황 >


■소규모 임상시험에서 CRISPR 유전자 편집기술과 CAR-T 기술을 결합한 방식의 환자 맞춤형 종양 치료 가능성을 제시
○ 개인화된 암 치료법 개발을 위해 2개의 첨단 바이오기술을 결합한 새로운 치료방법으로, CRISPR 유전자 편집기술로 면역세포인 T세포를 고도화하여 암을 정교하게 더 잘 공격할 수 있도록 변형
- 고도화된 T세포는 환자의 종양별로 특징적인 돌연변이 단백질을 인식할 수 있도록 하여 암세포를 더 잘 찾아내어 파괴할 수 있도록 설계
○ 특히 이번 접근방법은 유방암과 결장암을 포함하여 고형암 환자 16명을 대상으로 소규모 임상시험을 실시하였는데,
- 혈액암, 림프암에 대해 효과를 보인 기존 CAR-T 기술의 한계를 뛰어넘어 고형암을 표적으로 치료할 수 있다는 데에 차별성을 보유
※ CAR-T 세포는 많은 혈액암 및 림프암 종양세포 표면에 발현되는 단백질을 인식하여 공격하는데, 고형암은 이러한 표면 단백질이 없어 인식이 어려우며 고형암은 암세포를 죽이기 위해 침투해야 하는 T세포에 물리적 장벽으로 작용
○ 연구팀은 고형암을 인식하여 파괴할 수 있는 T세포를 제작하기 위해 각 환자의 혈액 샘플과 종양 생검에서 추출한 DNA를 시퀀싱하여 종양에서는 발견되지만 혈액에서는 발견되지 않는 돌연변이를 탐색
- 그런 다음 알고리즘을 사용하여 T세포의 면역반응을 유도하는 돌연변이를 예측 및 검증하고 종양 돌연변이를 인식할 수 있는 T세포 수용체라는 단백질을 설계
- 각 환자별로 맞춰 설계된 수용체가 환자 유래 T세포에 발현될 수 있도록 CRISPR 유전자 편집기술로 변형된 T세포를 제작하여 환자에게 주입
※ 지금까지 임상에서 시도된 치료 중 가장 복잡한 치료법으로, 환자 맞춤형 T세포를 설계하고, 제작하는데 1년 이상이 걸리는 경우도 있었음
치료 효능은 낮았지만 새로운 치료 접근방식에 대한 가능성을 확인하였고, 향후 면역세포를 더 정교하게 다루는 기술이 발전하면서 가능성은 더욱 확대될 것으로 기대
○ 임상시험 참가자 16명 각각은 최대 3개의 서로 다른 암 돌연변이를 인식하는 수용체 유전자가 편집된 T세포로 테스트를 진행
- 그 후, 편집된 T세포가 혈액에서 순환하는 것을 발견하였으며, 종양 근처에서 편집되지 않은 세포보다 더 높은 농도로 존재하는 것을 확인
- 치료 한 달 후 참가자 중 5명은 종양이 자라지 않은 안정적인 상태를 보였으나, 2명은 부작용이 나타남
○ 연구팀은 새로운 접근방식의 안전성을 확보하기 위해 상대적으로 적은 양의 T세포를 사용하여 치료 효능이 낮았던 것으로 파악하며, 다음에는 더 많은 양의 T세포를 주입해야한다고 설명
- 또한 환자 맞춤형으로 유전자가 편집된 T세포의 설계 및 제작, 배양시간을 줄이는 반면에 배양된 T세포 양을 늘리는 등 관련 기술의 고도화를 통해 새로운 면역세포 치료기술의 효능은 더 높아질 것으로 전망
○ CRISPR 유전자 편집기술을 사용하여 T세포를 편집하는 최근의 기술 발전 덕분에 정교한 면역세포 설계가 가능해졌으며, 향후 10년 안에 면역세포를 조작하는 매우 정교한 수단이 등장할 것으로 기대
- 종양세포는 면역억제 화학신호를 방출하여 면역세포의 활동을 방해하고, 빠른 성장을 촉진하기 위해 국부적으로 공급되는 영양소를 모두 사용함 으로써 면역반응을 억제하기도 하는데,
- 유전자 편집을 통해 면역억제 신호에 반응하는 T세포의 수용체를 제거하거나 종양 환경에서 에너지원을 더 쉽게 찾을 수 있도록 대사를 조정함으로써 T세포를 강화하는 몇 가지 잠재적인 방법을 연구 중
참고2 CAR-T 다음의 차세대 항암 면역세포치료제
| ◇ 지난해 미국 FDA가 2개의 CAR-T 치료제를 허가하면서 유전적으로 엔지니어링된 항암 면역세포치료제 시장이 개막. 최근 Science(361호, 2018.9.14.)에서는 CAR-T 치료제의 단점을 보완할 수 있는 차세대 항암 면역세포치료제로서 다른 종류의 면역세포인 NK(Natural Killer cells)와 macrophages로 제작된 CAR-NK와 CAR-macrophage의 가능성을 설명 ▸주요 출처 : Science, New cancer-fighting cells enter trials, 2018.9.14.; 국가항암신약 개발사업단, NK 세포를 이용한 차세대 항암면역세포치료제 개발, 2018.7.19 |
■지난해 미국 FDA는 2개의 CAR-T 치료제(노바티스社 킴리아, 길리어드社 예스카타)를 승인
○ 2017년 8월 CAR-T 치료제로서는 최초로 노바티스의 ‘킴리아(Kymriah)’를 승인한 데 이어 같은해 10월에 길리어드의 ‘예스카타(Yescarta)’를 승인
- 승인받은 2개 제품 모두 혈액암인 백혈병 치료제이지만, 킴리아는 난치 재발성 급성 림프구성 백혈병 치료제로 허가된 반면, 예스카타는 미만성 거대 B세포 림프종 대상으로 세부 적응증에서 차이
○ CAR-T(Chimeric Antigen Receptor-T Cell) 치료제는 환자의 T 세포에 암세포를 항원으로 인식하는 수용체 유전자를 도입하여 암세포를 보다 효과적으로 파괴할 수 있도록 개발된 치료제로,
- 기존 항암제로는 치료가 어려웠던 혈액암 등에 대해서 뛰어난 효과를 나타내는 것으로 주목
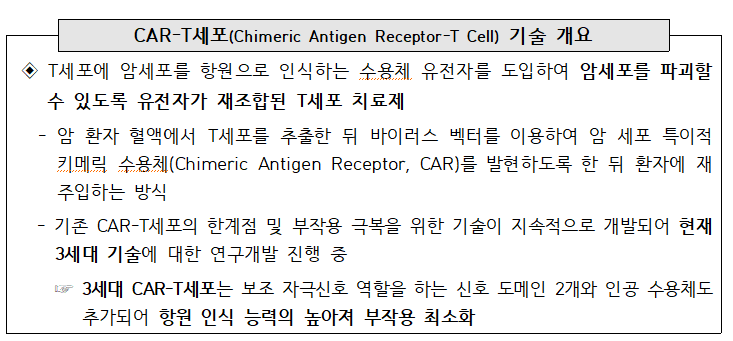
○ 최초의 CAR-T 치료제인 킴리아 허가는 암 치료분야에서 새로운 전기를 마련한 것으로 평가
- CAR-T 치료제는 혈액암 치료에서 기존의 약물이나 항체치료제보다 효과적 이며, 유전적 엔지니어링을 통해 다양한 암을 치료할 수 있는 잠재성을 보유한 것으로 평가
- CAR-T 치료제는 가장 비싼 항암제로 그 경제적 효과가 매우 클 것으로 기대. 킴리아의 1회 주사비용을 47.5만달러(약 5.4억원)로 책정
※ 미국국립암센터는 매년 20대 이하 환자가 약 3,100명가 발생하는 것으로 추산. 킴리아의 치료대상이 되는 환자(초기 치료 후 반응이 없거나 재발된 환자)를 15~20% 정도로 추산되는 바, 노바티스가 얻을 이득을 계산하면 미국에서만 한해 약 2.2∼3억달러(약 2,500∼3,400억원)가 될 것으로 추정
- 또한 환자 맞춤형 치료를 구체적으로 구현하여 그 효능을 입증한 치료제
※ 종양 치료에서 환자 개인맞춤 치료는 향후 전개될 암 치료의 주요한 방향이고 CAR-T는 이를 충족시킬 수 있는 이상적인 치료법으로 자리잡게 될 것으로 전망
○ CAR-T 치료제는 환자 자신의 T세포를 이용하여 복잡한 유전적 엔지니어링 과정을 거처야 하고, 환자 1인을 위한 수억원에 달하는 고가의 맞춤 치료라는 점이 오히려 산업화의 허들로 작용
- 또한 표적세포를 만나면 빠르게 분열하는 T세포의 특성으로 인하여 사이토카인 폭풍(Cytokine storm, Cytokine release syndrome, CRS) 및 중추신경계의 부종 등과 같은 부작용 우려
- T세포의 memory 기능으로 오랫동안 체내에 남아 재발할 경우 언제라도 동일한 부작용이 불시에 발생할 수 있다는 문제점 보유
○ Clonal expansion과 memory T세포는 유효성을 담보하는 바람직한 특성임과 동시에 관리되어야 하는 위험요소로 인식
- 이러한 문제점을 해결하기 위해 자살유전자를 추가로 주입한 CAR-T세포, 타인의 T세포에서 면역원성을 일으키는 유전자를 제거하여 동종 CAR-T 치료제를 만들고자 하는 시도가 이루어지고 있으나,
- 이는 더 복잡한 공정을 요구하고 있으며, CRS 문제로 인한 부작용 사례가 보고되는 등 근본적인 해결방안 요구
※ 킴리아와 예스카타의 주요 경쟁자로 언급되었던 주노테라피의 후보물질 (JCAR015)은 뇌부종으로 인한 5명의 사망자가 발생함에 따라 2016년 임상시험을 중단한 바 있음
■최근 Science에서는 CAR-T 치료제의 단점을 보완할 수 있는 차세대 항암 면역세포치료제로서 CAR-NK와 CAR-macrophage를 주목
○ 자연살해세포(Natural Killer Cell, NK cell)는 종양세포나 바이러스 감염세포 등 비정상세포를 즉각적으로 인식하여 제거할 수 있다고 알려진 면역세포로,
- T세포와 비교할 때 memory 기능과 clonal expansion 기능이 약하므로 CRS 등의 위험이 상대적으로 적은 편
○ CAR-NK는 보다 빠르게, 저렴하게 생산할 수 있고, 안전한 것으로 평가
- NK세포의 특성 상 환자가 아닌 건강한 타인의 세포를 사용할 수 있기 때문에 환자 자신의 세포만을 사용해야 하는 CAR-T 치료제와 비교 하였을 때, 제작기간 및 비용을 단축할 수 있을 것으로 기대
※ 위와 같은 NK세포의 특성으로 인해 NK세포의 경우에는 세포뱅크 구축 가능
- 안전성 측면에서 기존의 많은 의약품이 NK세포의 활성을 증가시켜 주거나, NK세포 매개 면역반응을 유도하여 치료하는 방식으로 항암치료에 사용
- 최근 CAR-NK 대량배양기술 개발로 실용화를 위한 기반을 확보하여 기존 생산비용이 크게 절감될 것으로 예상
※ 동결제형기술의 발달로 환자가 원하면 언제든지 제공할 수 있는 off-the-shelf 개념의 치료제로 개발 중
○ 현재 CAR-NK 치료제 개발을 위해 미국을 중심으로 Fate therapeutics, Nkartra Therapeutics, NantKwest 등 스타트업들이 활동 중
- 국내에서는 녹십자랩셀, 한국생명공학연구원 등에서 CAR-NK를 개발 중
< 암세포(붉은색)를 공격하는 NK세포(노란색) >

'전문기술' 카테고리의 다른 글
| [전문기술] 바이오래드, 임상연구 최초로 유방암 변이 검출용 초고감도 다중화 디지털 PCR 분석 출시 (39) | 2024.04.03 |
|---|---|
| [전문기술] 3D 바이오프린팅으로 제작한 인간 뇌 조직 (39) | 2024.04.01 |
| [전문기술] LK-99 연구진, 美 물리학회서 '새 상온·상압 초전도체' 연구 발표 (36) | 2024.03.26 |
| [전문기술] 글로벌 의약품 시장 현황 및 전망 (49) | 2024.03.19 |
| [전문기술] 암 유발 물질 컴퓨터로 예측하다 (63) | 2024.03.18 |



