[바이오 세션] 마이크로바이옴 표적 항암백신 전략

◈ 목차
1. 마이크로바이옴과 암
2. 저변이 암이란?
3. 마이크로바이옴 표적 항암 백신의 개요
가. 면역항암 치료 전략 & 암백신
나. 마이크로바이옴 표적 항암 백신
4. 마이크로바이옴 표적 항암 백신 개발 전략
가. 항원 발굴
나. 항원 전달 기술 및 mRNA/지질나노입자 시스템
다. mRNA 기반 암 백신 연구 동향 및 시장 점유 가능성 분석, 차별화
◈본문
1. 마이크로바이옴과 암
마이크로바이옴(Microbiome)은 숙주 개체 내 살아가고 있는 바이러스, 박테리아 등의 군집으로, 대사(Metabolism)와 면역(Immune system)을 비롯한 숙주의 다양한 부분에서 역할을 한다[1]. 대표적으로 장내 미생물 군집(Gut microbiome)은 식이 섬유를 비롯한 다양한 음식물의 분해에 직접적으로 참여, 그 대사물을 통해 숙주에 영향을 미치게 되는데 short chain fatty acid와 tryptophan 대사물을 비롯한 대사 산물들이 암 환자의 면역항암요법에 대한 반응성[2][3], COVID-19 백신에 대한 면역 형성[4] 등에 긴밀히 연관되어 있음이 보고되었다.
일부 박테리아를 비롯한 감염성 요인에 의한 암 발생은 전체 중 약 16% 이상을 차지하는 것으로 알려져 있으며, 종양 환경 내 박테리아의 존재는 수 세기 이전에 처음으로 보고되었다[5]. 종양 내 박테리아의 발견 이후, Wilhelm Busch와 Friedrich Fehleisen, William Coley를 비롯한 여러 학자들이 Streptococcus 종에 의한 종양의 자연적인 치료를 보고하였고, 한때는 Thomas Glover와 Virginia Livingston-Wheeler에 의해 박테리아가 종양의 근원임이 주장되기도 하였으나, 그 후 바이러스와 Somatic mutation이 주요한 암 발병의 근원으로 밝혀지게 되면서 해당 주장은 일단락되었다[6]. 그럼에도 종양 내 박테리아 군집은 여전히 일부 암의 원인이 될 수 있고 암의 병리학적 특성, 암의 성장 및 진단에 긴밀하게 연관되어 있음이 지속적으로 보고 되어 왔으며 최근 연구들에서는 종양 내 미생물 군집(Tumor microbiome)의 특성 분석 시도가 꾸준히 이루어져, 암 종마다 특정 박테리아 종이 존재함이 확인되었다. 또한 이러한 종양 특이적 박테리아 군집은 주로 암세포 뿐만 아니라, 종양 환경 내 면역세포 등의 세포 내부에 존재함 또한 밝혀지기도 하였다[7].
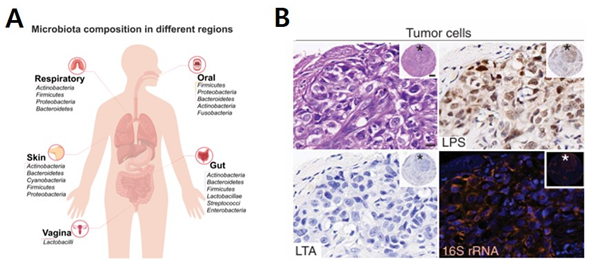
[그림 1] 신체 내 마이크로바이옴 & 종양 환경 내 박테리아의 존재
출처 : A– Kaijian Hou et. al. 2022, B- Deborah Nejman et. al. (2020)
최근 한 연구에서는 1. 종양 환경 내 박테리아들이 암 또는 면역세포의 내부에 존재한다는 점[7]과, 2. 일부 박테리아 Epitope들이 MHC-I과의 complex 형성을 통해 항원으로서 작용할 수 있다는 기존 연구 내용들[8]에 근거하여, 종양 내 Anaerobic 박테리아를 표적으로 하는 항생제-나노입자를 개발하였으며, 해당 나노입자가 주입된 대장암 동물모델에서는 종양 환경 내 사멸된 박테리아의 Epitope들이 체내의 유사(Homologous) 또는 비유사(Heterologous) 항원으로 작용하여 CD8+T세포에 의한 면역항암 치료 효과를 유도할 수 있음이 보고 되기도 하였다[9].
종합적으로 이러한 연구들은 종양 환경 내 박테리아·미생물 군집을 표적으로 하는 것이 여러 가지 난치성 암을 치료하는데 있어서 새로운 전략을 제시할 수 있음을 시사하며, 특히 난치성 암의 대표 종류인 저변이 암에 대해 큰 적용 가능성을 내포하고 있다. 추가적으로, 본 원고에서는 바이러스 외의 마이크로바이옴, 특히 박테리아를 해당 전략의 주요 표적으로 하여 내용을 서술한다.

[그림 2] 신종양 환경 박테리아 단백질의 T세포 자극 및 신생항원으로서의 작용
출처 : Menglin Wang et. al. (2023)
2. 저변이 암이란 ?
앞서 설명하였듯, 암은 유전자 변이(Mutation)에 의해 발생하게 된다. 정상세포에서 암의 발병까지 보통은 오랜기간 동안 유전자 변이의 축적이 이루어지게 되며[10], 이러한 유전자 변이 중 일부는 유전자로부터 발현되는 단백질의 원래 서열과는 다른 서열을 발현하도록 한다. 이렇게 원래 서열과는 다른 서열로 발현된 일부는 항원성을 띄게 되고, 이것들이 신생항원(Neoantigen)으로서 작용하게 되는데, 신생항원의 빈도나 질은 암종류마다, 그리고 암환자마다 차이가 존재한다[11]. 그리고 암들 중에서도 상대적으로 유전자 변이가 적은 암들은 저변이 암(Low mutational burden tumor)으로 분류되며, 이러한 암들은 결국 선천적으로 낮은 빈도·질의 신생항원을 보유하게 된다. 이것은 암백신, 면역관문억제제와 같이 T세포의 반응에 의존적인 것으로 알려진 면역항암치료 전략의 효과에 크게 영향을 미치며, 실제로 이러한 이유로 종양의 mutational burden과 신생항원의 항원성 등이 면역항암치료 효과를 예측하기 위한 주요 지표로 사용되고 있다[12]. 추가적으로, 여러 암 종류 중에서도 전립선암과 췌장암, Microsatellite stable(MSS) 대장암 등이 대표적인 저변이 암으로 잘 알려져 있으며, 저변이 암들은 주로 유전자의 Microsatellite 부분이 안정적이고 변이가 잘 일어나지 않는 특징을 가지고 있다[13].
3. 마이크로바이옴 표적 항암 백신의 개요
가. 면역항암 치료 전략 & 암백신
면역항암치료는 면역세포들을 활성화하고 암세포에 대한 면역 반응을 유도함으로서 암세포들이 제거되도록 하는 항암치료 전략으로, 대표적으로는 면역관문억제제(ImmuneCheckpointInhibitor)가 있다[14]. 면역관문억제제는 T세포의 PD1 또는 CTLA4와 같은, 면역관문 물질에 의한 억제 신호를 저해함으로써 암세포에 대한 공격을 활성화하고 제거한다. 이러한 과정에서 T세포가 암세포를 인식하는 데는 암세포가 가진 변이 유전자 또는 이로부터 발현된 변이 펩타이드 서열 또는 신생항원에 의존하게 되는데, 즉 암세포가 가진 유전자 변이가 신생항원(Neoantigen)으로 작용하는 것이 T세포가 암세포를 적으로 간주할 수 있게 되는 주요 원리이다[11].
마찬가지로, 암백신은 암세포가 가진 변이 유전자로부터 만들어진 신생항원을 인공적으로 전달하여, 그에 대한 T세포 면역을 비롯한 적응면역(Adaptive immune)을 유도하여 암세포를 사멸시키는 전략으로[15] 이 역시 주로 CD8+ T세포의 신생항원 인식 능력에 기반한다. 결국, 면역항암치료 전략은 근본적으로 변이 유전자 및 신생항원에 의존하기 때문에 챕터 2에서 설명한 것과 같이 저변이 암에서는 적용하는데 한계가 있게 된다.

[그림 3] 낮은 신생항원 빈도에 따른 저변이 암의 면역항암치료 제한
출처 : Wikipedia, BioRender.com
나. 마이크로바이옴 표적 항암 백신
챕터 1과 2의 내용에 근거하여 종양 환경 내 특정 박테리아를 표적으로 하는 mRNA, 펩타이드 등의 백신은 다양한 난치성 암을 타겟으로하여 항암백신 적용·개발이 가능할 것으로 보이며 특히 저변이 암과 같은, 선천적으로 유전자 변이 및 신생항원(Neoantigen)을 적게 보유하고 있는 암을 대상으로 하는 면역항암 치료 전략이 될 수 있을 것으로 기대된다. 해당 전략은, 암 종에 따른 특이적 미생물 또는 박테리아를 선별하고, 해당 미생물이 발현하는 항원성 단백질 또는 펩타이드를 발굴하여, 이들의 MHC-I 결합 및 항원성을 평가하는 시스템을 구축한다. 발굴된 항원성 펩타이드 또는 그것들의 군집을 생체내로 효과적으로 전달하고, 그에 따른 면역반응을 최대로 유도할 수 있는 전달시스템·플랫폼을 개발한다. 대표적으로 mRNA를 이용한 항원 펩타이드 발현 및 전달은, RNA가 갖는 선천적 면역반응과 과량의 항원을 하나의 mRNA로부터 번역할 수 있다는 장점이 있기에 다른 시스템 대비 마이크로바이옴 표적 항암 백신 개발에 더욱 적용 가능성이 높은 시스템이다. 또한, 지질나노입자 시스템은 이전의 COVID-19 mRNA 백신을 통해 증명된 현존하는 최적의 mRNA 전달 기술이다[16, 17]. 이에 따라, 본 원고에서는 mRNA/지질나노입자 기반의 마이크로바이옴 표적 항암 백신을 우선적인 후보 전략으로 논의, 이에 관한 내용을 주로 서술한다.
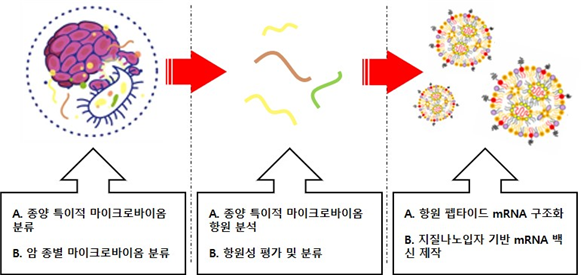
[그림 4] 마이크로바이옴 표적 항암 백신
출처 : 한국생명공학연구원, KRIBB
4. 마이크로바이옴 표적 항암 백신 개발 전략
가. 항원 발굴
마이크로바이옴 표적 항암 백신의 개발을 위해서는 항원을 발굴하는 것이우선적으로 수행되어져야 한다. 앞서 보고되었듯, 종양 샘플 내의 마이크로바이옴 종 분석은 조직 내 그 유전체의 샘플 양이 많지 않고, 동시에 외부 오염에 취약하다는 특징이 있다[7]. 따라서 이러한 점들을 고려하여 종양 환경 내 박테리아를 비롯한 마이크로바이옴의 유전체를 Next generation sequencing과 같은 분석법으로 분석하고, 후보 박테리아 또는 미생물 종을 선별, 암 종에 따른 마이크로바이옴의 분석 및 구분, 데이터화를 진행할 필요가 있다[7].
암 종에 따른 박테리아 및 후보 미생물들이 선별된 후 최적의 항원을 표적으로 하기 위해서는 암세포 또는 환경 내 가장 빈도 높게 존재하는 미생물 종들을 우선으로 하여 Proteomic 분석, MHC 결합 분석 등을 수행해야 한다. 이전에 발표된 연구에서는 Proteomic 분석을 통해 특정 박테리아 내의 단백질들을 세포 내 구획 별로 구분, 분석하고 그들 중 상대적으로 세포 내 가장 높은 비율로 존재하는 단백질들을 서열화하였다. 그리고 그중에서 MHC class I과의 결합이 가장 높을 것으로 예상되는 펩타이드 서열을 Immune Epitope Database(IEDB)를 통해 예측하고 항원으로 작용할 수 있는 단백질·펩타이드를 선정하였다[9]. 흥미롭게도 발굴된 항원 펩타이드들은 암에서의 신생항원(Neoantigen)과 유사한 항원성을 띄고, 면역반응을 유도함이 관찰되었다.
MHC-I과의 결합 능력 및 항원성은 실제 암세포의 사멸을 일으키는 CD8+T세포 반응과 직결되기 때문에 MHC-I 결합 능력은 암 백신 개발 시 신생항원(Neoantigen) 발굴에서 매우 중요하게 고려되는 요소이다. 따라서, IEDB, Neopepsee, NetCTLpan 등 MHC-I 결합 능력을 기반으로 항원성을 예측하는 다양한 프로그램을 사용하여 마이크로바이옴 표적 항원을 검증할 필요가 있다[9, 18].
추가적으로, 최근 Plague 균에 대한 개발, 보고된 mRNA 백신 연구를 참고하자면 박테리아 항원의 불충분한 항원 능력을 보완하고자 항체의 Fc(Fragment crystallizable region) 부분을 재조합하였고, 이러한 형태의 재조합 항원이 Plague 균에 대한 충분한 면역을 구축할 수 있음이 관찰되었다[19]. 이러한 전략은 우수한 백신 효과와 항암치료 효과를 유도하는데 필요할 것으로 생각된다.
[그림 5] 항원 선별을 위한 MHC 결합 분석 Tool
출처 : https://www.iedb.org/, https://services.healthtech.dtu.dk/services/NetCTLpan-1.1/
나. 항원 전달 기술 및 mRNA/지질나노입자 시스템
우리 몸에 전달된 항원 단백질 또는 펩타이드는 수지상세포로부터 항원 표지(Antigen presentation)가 이루어지고 그에 의해 T세포 반응 등이 유도되게 된다. 이러한 과정에서 얼마나 효율적으로 항원이 우리 신체로 전달되고 그에 세포들이 노출되는지의 정도에 따라 백신의 효과가 크게 좌우되며, 따라서 전달 기술 개발은 마이크로바이옴 표적 항암 백신 개발에서도 핵심기술이 될 수 있다[16].
① mRNA 백신 & 지질나노입자 시스템
mRNA 백신은 항원 단백질을 발현하는 mRNA를 사용하는 백신 전략으로, COVID19 판데믹을 기점으로 Moderna와 Pfizer가 개발한 mRNA 백신이 성공적으로 감염병의 확산을 예방함에 따라 mRNA 백신의 우수성과 다양한 감염병에 대한 적용 가능성이 검증되었다[17].
mRNA 백신의 구성은 항원을 발현하는 mRNA와, 이것을 생체 내로 전달하기 위한 전달 기술로 이루어져 있고, 현재로서는 지질나노입자(Lipid nanoparticle) 시스템이 가장 발전된 형태의 mRNA 전달 기술이다[16]. mRNA의 세포·생체 내 전달을 극대화하기 위해 개발된 지질나노입자 시스템은 보통 ~100 나노미터의 크기를 가지며 이온화지질을 비롯한 4종 이상의 지질들로 구성되어 있다. 이 중에서도 신규 이온화지질의 구조를 발굴하고 확보하는 것은 지질나노입자 기술 선점에서 큰 비중을 차지한다. 지질나노입자는 mRNA의 보호 및 세포 내 전달 기능 외에도 백신으로서의 기능에 적합한 면역원성을 띄고 있으며, 결국 하나의 mRNA로부터 발현된 여러 개의 항원과, 지질나노입자가 갖고 있는 선천적인 면역원성이 조합되어 항원에 대한 강력한 면역반응을 유도하는 것이라 볼 수 있다[20, 21]. 이러한 특성 및 장점에 기반하여 mRNA/지질나노입자 시스템은 각종 감염병과 암 백신 개발에 적용되고 있으며 마이크로바이옴 표적 항암 백신 개발에서도 가장 우선적으로 고려 되어야 할 것이다.
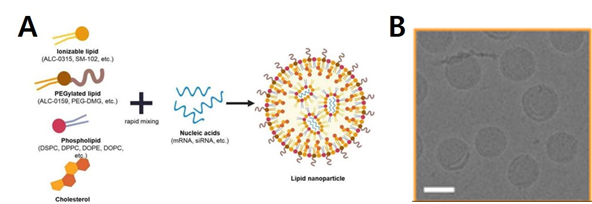
[그림 6] mRNA 백신의 구성성분(mRNA, 지질나노입자) & 지질나노입자의 형태
출처 : A- Han Na Jung et. al. 2022, B- Yong et. al. (2024)
② mRNA 백신 관련 최근 연구 동향 및 지향점
최근에는 자가복제형 mRNA[22] 또는 원형 RNA[23] 적용, 지질나노입자의 변형[21, 24, 25] 등을 통해 백신으로서의 기능성 향상을 시도한 연구들이 보고되었으며, 대표적으로 지질나노입자의 구성성분에 TLR(Toll-ike receptor) agonist, STING agonist, 마이크로바이옴 대사물이 결합된 지질을 포함시킴으로서 면역반응을 증가시키고, 궁극적으로는 항원 특이적인 항체반응과 T세포 반응을 향상시킴이 보고되었다. 이러한 전략들은 마이크로바이옴 표적 항암 백신 개발에서도 그 효과를 극대화하기 위한 방향성을 제시하고, 특히 앞서 설명하였듯 암백신 효능에서 가장 중요한 T세포 반응을 강력하게 유도할 수 있는 mRNA/지질나노입자 시스템을 개발하는 것이 핵심 전략이 될 것으로 보여진다.
추가적으로, mRNA 백신의 우수성과 마이크로바이옴 표적 항암 백신 적용 가능성에도 불구하고 한가지 고려해야 할 측면이 있는데, 박테리아 또는 미생물들의 단백질 번역 후 변형 기전이 우리 몸의 세포 내 기전과 다르다는 점이다. 대표적으로는 단백질의 항원성에 크게 기인하는 것으로 알려진 당화(Glycosylation)가 이러한 기전에 포함되며, 따라서, mRNA 형태로 박테리아/마이크로바이옴 항원을 전달, 세포 내에서 발현되는 것이 실제 박테리아로부터 생산된 항원과 생체 내에서 면역 반응을 유도하는 데에 어떠한 차이가 발생할지 예측, 비교 분석할 필요가 있다[26].
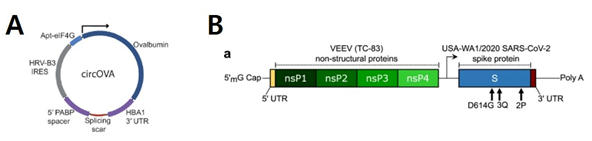
[그림 7] 최근 연구동향 1) 원형 RNA & 자가복제형 mRNA
출처 : A- Laura Amaya et. al. 2023, B- Emily A. Voigt et. al. (2022)
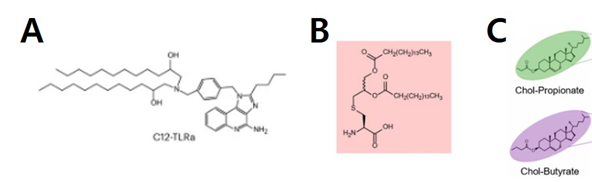
[그림 8] 최근 연구동향 2) 지질나노입자의 면역원성 향상용 지질 구성성분
출처 : A- Xuexiang Han et. al. (2023), B- Yangzhuo Gu et. al. 2023, C- Yong et. al. (2024)
다. mRNA 기반 암 백신 연구 동향 및 시장 점유 가능성 분석, 차별화
2023년 기준, 약 35건의 mRNA 기반 암 백신이 임상 시험을 진행 중인 것으로 보고되었으며, Colorectal cancer, gastric cancer, melanoma, ovarian cancer 등을 비롯해 다양한 고형암을 표적으로 하고 있다[27]. 이들 중에서도, Moderna와 BioNTech 사에서 가장 활발하게 연구 개발을 진행하고 있는 것으로 보여지며, Moderna 사의 경우 암 종류에 따라 20~34개의 다양한 신규항원을 표적으로 하여 mRNA 백신을 개발하고 있음을 알 수 있다.
대표적으로, Moderna 사의 mRNA-4157은 환자 맞춤형의 34종 신규항원들을 표적으로 Pembrolizumab과 병용 투여를 통해 흑색종 환자에게 적용, 현재는 해당 조합의 임상 3상 시험이 진행되고 있다[28]. 또한 Memorial Sloan Kettering Cancer Center 연구진과 BioNTech 사는 20종의 신규항원을 표적으로 하는 췌장암 환자 맞춤형 mRNA 암 백신을 개발하고 그에 의한 항원 특이적인 T세포 면역 반응과 효과를 검증하는 등 임상 1상 시험을 최근 진행한 바 있다[15]. 그 외, BioNTech사에서 개발된 BNT211-01(CARVac)의 경우 CAR-T세포의 항암치료 효과를 증대하기 위해 CAR-T 세포가 인지하는 CLDN6 항원을 mRNA 백신 형태로 전달하는 기술로[29], 얼마 전 고형암 환자를 대상으로 임상 1상 시험이 진행, 효과가 검증된 바 있다[30].
위 사례들과 같이 현재는 고형암과 암세포의 신생항원을 직접 표적으로 하는 mRNA 기반 암 백신들이 주로 연구개발 되고 있으며, 또한 저변이 암을 주요한 대상으로 개발 중인 암 백신은 없는 것으로 확인된다. 이러한 시점에서 종양 환경 내 마이크로바이옴 표적 항암 백신 기술은 저변이 암과 같은 난치성 암을 주요 대상으로 하는 암 백신 기술로서 개발 가치가 있을 것으로 사료되며, 향후 난치성 암 백신 시장 점유 가능성, 차별성 등을 가질 것이라 볼 수 있다.
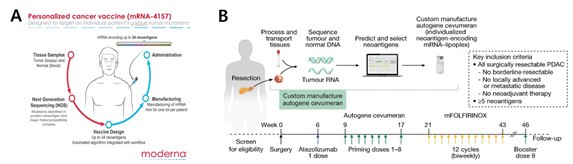
[그림 9] 임상 단계의 개인 맞춤형 mRNA 암백신
출처 : A- Moderna, B- Luis A. Rojas et. al. (2023)
'바이오세션정보' 카테고리의 다른 글
| [바이오 세션정보] 박테리아에서 새롭게 발견한 역전사효소 기반의 바이러스 방어 기전 (48) | 2024.06.04 |
|---|---|
| [바이오 세션] 헬스케어 분야 인공지능의 성장 기회 (64) | 2024.05.28 |
| [바이오세션] 인공지능(AI)으로 전이성 암세포의 기원을 식별 (75) | 2024.04.23 |
| [바이오 세션] 미래의 미생물 식품은 친환경적으로 생산할뿐더러 영양과 맛까지 갖춰 소비자들의 선택을 받는 완전식품이 될 것이다. (45) | 2024.04.12 |
| [바이오 세션] 글로벌 의료사물인터넷 동향 (42) | 2024.04.11 |



