[전문기술] ‘손상된 세포막 복구기전 밝혀져!’ 세포막 보호를 위한 단백질 패치가 만들어지는 새 기전 규명

손상된 세포막의 복구과정에 대한 자세한 기전이 국내 연구진에 의해 세계 최초로 밝혀졌다.
고려대학교(총장 김동원) 생명과학부 송현규 교수 연구팀은 “세포막이 손상되었을 때 복구되는 과정에서 결정적인 역할을 하는 TRIM72 단백질이 어떻게 생체 내에서 작동하는지 분자기전을 규명”했다고 밝혔다. 연구 결과는 구조 및 분자 생물학 연구분야 세계적 전문학술지인 네이처 구조 분자생물학(Nature Structural Molecular Biology, IF=16.8)에 런던 현지시각 9월 28일자(한국시간 9월 29일) 온라인으로 게재됐다. (논문 제목: Structure and activation of the RING E3 ubiquitin ligase TRIM72 on the membrane)
세포는 인지질막을 이용하여 세포 내부의 물질들을 외부로부터 보호한다. 세포막 손상을 입으면 세포는 살아갈 수 없을 뿐만 아니라 염증성 질환, 비정상 세포 성장, 감염성 질환, 신경 장애 등 거의 모든 생명현상에 직접적인 영향을 준다. 따라서 세포막이 손상되면 세포는 신속히 복구하는 기전을 가지고 있고 이는 생명현상을 유지하는 필수적인 방법이다.
TRIM72 단백질은 TRIM이라고 불리는 70여 개의 단백질 군의 하나로 E3 유비퀴틴 리가아제이다. 따라서 기질 단백질에 유비퀴틴을 결합시키는 효소 활성을 가지고 있으며 가장 잘 알려진 생체 내 기능은 손상된 세포막 복구이다.
기존 네이처 셀바이올로지에 발표된 바에 의하면 TRIM72 단백질은 근육 세포막이 손상을 받았을 때 세포막 주위로 모여들고 세포막이 복구되기 위한 시간을 벌어주는 것으로 알려져 있었다.
현재까지 70여개 TRIM 군의 단백질 중 전체 구조가 밝혀진 것은 하나도 없을 뿐만 아니라 TRIM72 단백질이 어떻게 세포막 복구에 관여하는지에 대한 명확한 연구결과도 보고되지 않았다.
이번 연구에서 연구팀은 TRIM72 이량체(dimer)의 전체 구조(full-length)를 세계 최초로 규명하였고(그림 1), 더 나아가 세포막 위에서 어떠한 모양의 다량체(oligomer)를 만드는지 구조를 밝혀서(그림 2) 세포막이 손상되었을 때 패치처럼 붙어서 순간적으로 세포막이 더 이상 손상을 입는 것을 막는 기전을 밝힌 것이다.
TRIM72 단백질은 이량체로 용액상에서 존재하며 가운데 PRYSPRY 도메인을 중심으로 좌우에 긴 형태의 coiled-coil 구조를 가지고 있다(그림 1 참조). RING과 B-박스 도메인 coiled-coil 구조 외각 방향으로 존재한다. 그림 1에서 보는 것 처럼 TRIM72 단백질의 전체 구조는 날개를 편 새의 모습과 흡사하다.
이러한 TRIM72 단백질은 세포막이 손상되었을 때 세포막에서 고차원(high-order)의 다량체를 형성하면서 세포막을 외부로부터 보호한다. 이러한 세포막 위의 다량체 경우도 특정한 모양을 이루는데 이 구조를 극저온 전자 단층촬영법(Cryo-electron tomography)을 이용하여 시각화하였다(그림 2).
또한 본 연구에서 이량체의 TRIM72 E3 유비퀴틴 리가아제의 활성은 극히 낮지만 세포막에서 고차원 다량체를 이뤘을 때는 효소 활성이 증대되는 것도 생화학적으로 증명하였다(그림 3).
고려대 송현규 교수는 “이번 연구는 구조생물학의 여러 가지 기술인 X-선 결정학, X-선 소각산란법, 극저온 전자현미경, 극저온 전자 단층촬영법을 총동원하여 TRIM72 분자의 용액상 구조와 생체막에 결합된 형태의 구조를 세계 최초로 밝힌 것이다. 구조 정보를 기초로 생화학 및 세포생물학적 연구를 추가로 진행하여 손상된 세포막이 어떻게 TRIM72 단백질에 의해서 복구되는지에 대한 명확한 해답을 얻었다.”고 연구의 의의를 설명했다.
이 연구는 과학기술정보통신부․한국연구재단 중견연구자사업 및 바이오의료기술사업의 지원으로 수행됐다.
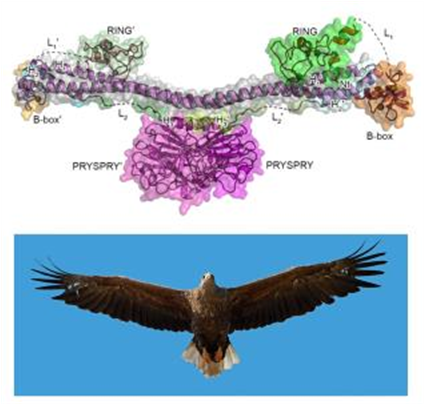
그림 1. 용액상에서의 TRIM72 이량체(dimer)의 구조(위). 날개를 편 새와 비슷한 모양을 하고 있음(아래). 단량체(monomer)의 좌우로 뻗은 coiled-coil 도메인은 새의 날개처럼 위아래 방향으로 잘 움직임. 가운데 위치한 PRYSPRY 도메인(분홍색)은 새의 몸통과 비슷하며 아래쪽에 양전하를 띈 아미노산들이 존재하는데, 이를 이용해서 생체막에 결합함. 이는 새가 발(톱)을 이용해서 나뭇가지에 착지하는 것과 유사함.

그림 2. TRIM72 단백질이 세포막 위에서 다량체를 이룰 때에도 무작위적으로 모이는 것이 아니라 특정 형태를 갖추면서 복합체를 이룸. (왼쪽, 위/아래) 극저온 전자 단층촬영법(Cryo-electron tomography)으로 데이터를 수집하고 subtomogram averaging이라는 방법으로 해상도를 높여서 만든 구조. (오른쪽 위) 와플의 구조인데 위에서 보면 TRIM72 복합체와 형태가 유사함. (오른쪽 아래) TRIM72 복합체를 측면에서 보면 coiled-coil이 다리 윗면처럼 연결되어 있고 교각의 기둥은 PRYSPRY 도메인들과 비슷하게 특정 간격으로 구분되어 있음. TRIM72 복합체 아래쪽은 세포막이고 오른쪽 사진에서는 강물에 해당함.

그림 3. TRIM72 단백질이 손상된 세포막을 복구하는 기전을 보여주는 모델. 용액상에 이량체로 존재하는 TRIM72 단백질은 아미노-말단 쪽에 존재하는 RING 도메인을 매우 자유롭게 움직여서 E3 리가아제 활성이 낮음. 세포 내에 인지질막으로 구성되어있는 베지클 등에 잘 결합하고, 베지클에 있을 때 또는 플라스마 세포막에 존재할 때는 고차원(high-order)의 다량체(oligomer)를 이뤄서 손상된 부위에 붙이는 반창고처럼 패치처럼 더 이상의 손상을 막아줌. 다량체가 만들어지면 옆 분자의 RING 도메인과 이량체(dimer)를 잘 만들기 때문에 E3 유비퀴틴 리가아제 활성 또한 상승함.
출처 : BRIC
'전문기술' 카테고리의 다른 글
| [전문기술] 새로운 바이오 소재가 직접 생선 내장에 약물을 전달합니다 (140) | 2023.10.13 |
|---|---|
| [전문기술] Dow는 화장품 포장에 사용하기 위해 바이오 및 플라스틱 폐기물로부터 이오노머를 도출했습니다 (109) | 2023.10.05 |
| [전문기술] 단일세포 다중오믹스 분석 (407) | 2023.09.27 |
| [전문기술] 펠리컨과 원시 유전학의 합병으로 인한 원시적인 생물 꽃 (246) | 2023.09.21 |
| [전문기술] 레이저 자이로스코프는 지구상의 며칠동안의 아주 작은 변화들을 측정했습니다 (222) | 2023.09.20 |



